

Урок по химии
Легче чем кажется
Химические реакции в растворах на примере кислотно-основных индикаторов
Пройти урок




Урок по химии
Легче чем кажется
Химические реакции в растворах на примере кислотно-основных индикаторов
Пройти урок



Для понимания протекания химических реакций в растворах нам сначала нужно понять, что такое электролитическая диссоциация. Если кратко, то это процесс, при котором происходит распад (диссоциация) вещества на ионы при растворении или расплавлении. Для удобства мы будем рассматривать процесс распада веществ только при их растворении в воде.
KA ⇄ K (катион) + A (анион)
А что такое катионы и анионы? Давай посмотрим на анимацию


Посмотреть
+
-



К прошлой анимации
Далее
Для понимания протекания химических реакций в растворах нам сначала нужно понять, что такое электролитическая диссоциация. Если кратко, то это процесс, при котором происходит распад (диссоциация) вещества на ионы при растворении или расплавлении. Для удобства мы будем рассматривать процесс распада веществ только при их растворении в воде.
KA ⇄ K (катион) + A (анион)
А что такое катионы и анионы? Давай посмотрим на анимацию
+
-

Вещества, которые способны распадаться на катионы и анионы в растворе и в дальнейшем проводить электрический ток называются электролитами. В зависимости от того, насколько хорошо вещества распадаются на ионы, их можно разделить на слабые и сильные электролиты.
Сильные электролиты - вещества, которые практически полностью распадаются на ионы. Например, поваренная соль
Слабые электролиты - вещества, которые частично распадаются на ионы. Например, гидроксид кальция.
Сильные электролиты - вещества, которые практически полностью распадаются на ионы. Например, поваренная соль
Слабые электролиты - вещества, которые частично распадаются на ионы. Например, гидроксид кальция.

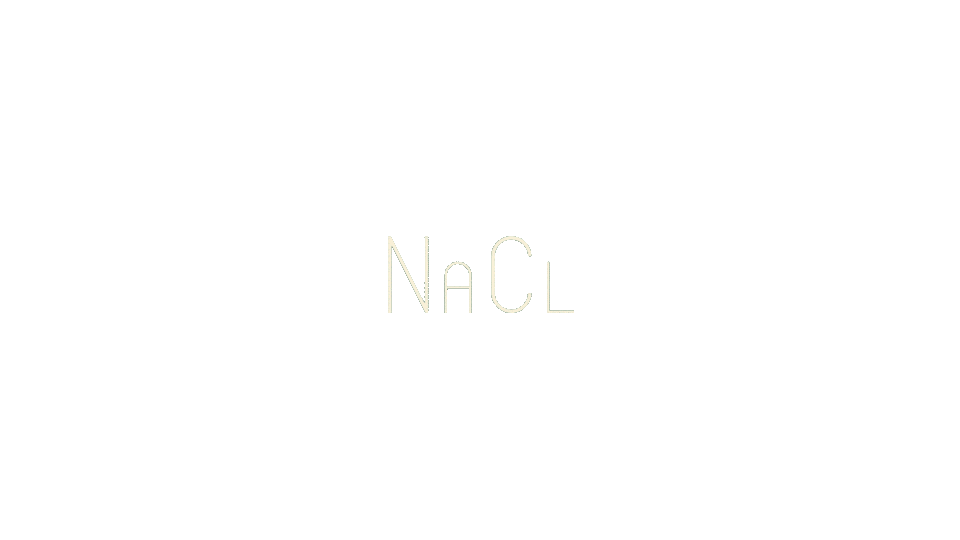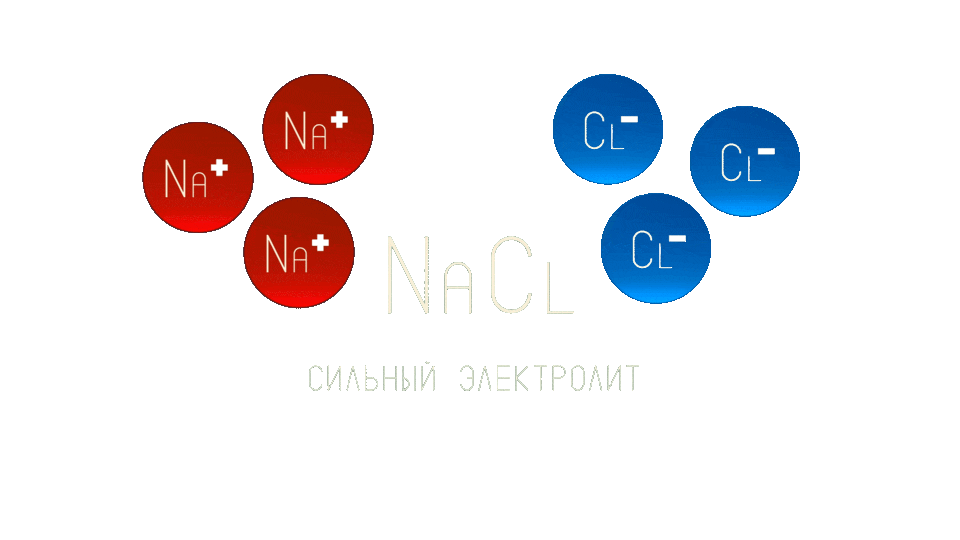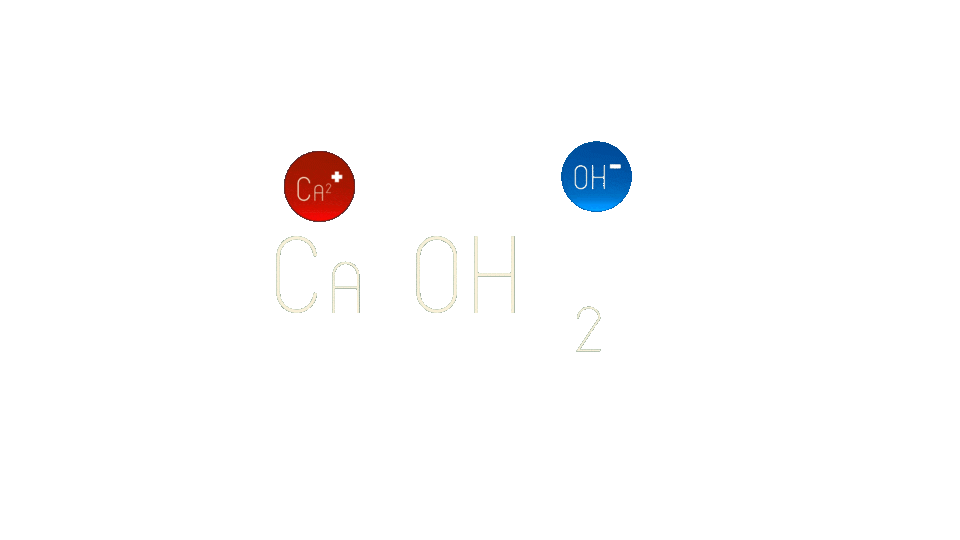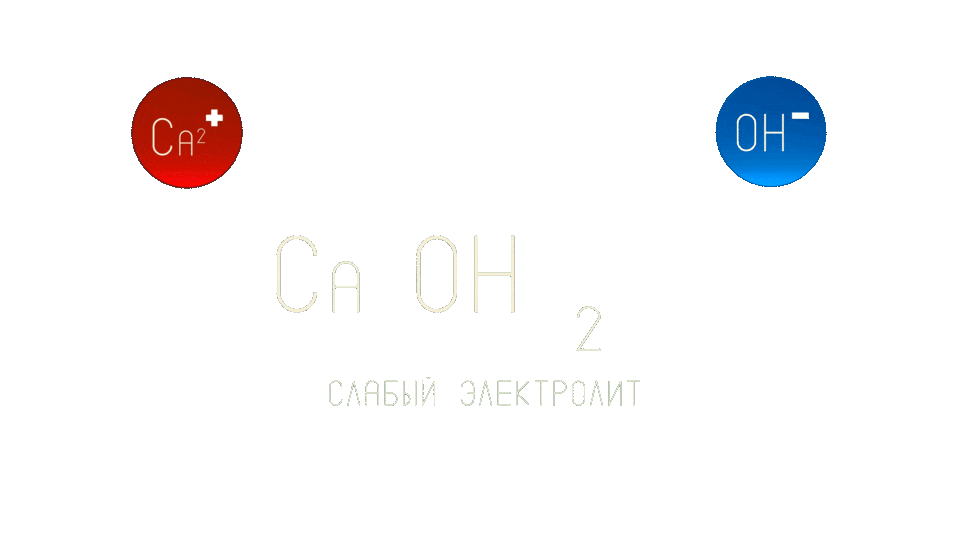
Далее

Для наглядной демонстрации давай соберем прибор, который покажет, может ли вещество проводить электрический ток и является ли оно слабым или сильным электролитом.
1.Подготовь три стакана с растворами следующих веществ:

- Чистая вода (бутилированная/ из-под крана)
- Раствор поваренной соли
- Раствор гидроксида кальция
2.Подключи светодиод к кроне как показано на схеме ниже:
3.Поочередно опускай свободные провода в стаканы с подготовленными растворами и смотри, какие изменения наблюдаются.

Далее
В зависимости от того, какие именно катионы и ионы получаются при растворении веществ, их можно разделить на три группы:
Кислоты - это вещества, при диссоциации которых образуются катион водорода и анион кислотного остатка (КО)
Кислоты - это вещества, при диссоциации которых образуются катион водорода и анион кислотного остатка (КО)
Основания - это вещества, при диссоциации которых образуются катион металла и анион гидроксогруппы
Соли - это вещества, при диссоциации которых образуются катион металла и анион кислотного остатка
Посмотреть
Посмотреть

В зависимости от того, какие именно катионы и ионы получаются при растворении веществ, их можно разделить на три группы:
Кислоты - это вещества, при диссоциации которых образуются катион водорода и анион кислотного остатка (КО)
Кислоты - это вещества, при диссоциации которых образуются катион водорода и анион кислотного остатка (КО)
Основания - это вещества, при диссоциации которых образуются катион металла и анион гидроксогруппы
Соли - это вещества, при диссоциации которых образуются катион металла и анион кислотного остатка
Посмотреть
Посмотреть

теория и небольшой интерактив.
В зависимости от того, какие именно катионы и ионы получаются при растворении веществ, их можно разделить на три группы:
Кислоты - это вещества, при диссоциации которых образуются катион водорода и анион кислотного остатка (КО)
Кислоты - это вещества, при диссоциации которых образуются катион водорода и анион кислотного остатка (КО)
Основания - это вещества, при диссоциации которых образуются катион металла и анион гидроксогруппы
Соли - это вещества, при диссоциации которых образуются катион металла и анион кислотного остатка

Посмотреть
Посмотреть
Далее

В таблице приведены примеры кислот, оснований и солей. При нажатии на каждоев ещество ты можешь посмотреть реакцию диссоциации каждого вещества


Далее
Примеры кислот
Примеры кислот
Примеры оснований






2
4
2
3
4
HCI
H SO
NaOH
Ba(OH)
NaCI
K PO







Для наглядного понимания реакций в водных растворах давай рассмотрим, как ведут себя в них кислотно-основные индикаторы. В водных растворах, помимо молекул воды (Н2О), есть еще множество других молекул и ионов.



Далее

Нам важна ключевая характеристика раствора — его рН (читается как «пэ-аш»).
PH показывает, какое количество ионов водорода Н+ и гидроксид-ионов ОН- содержится в растворе; pH измеряют в единицах — от 0 до 14.


Далее

Кислотно-основные индикаторы — это вещества, которые реагируют как раз на количество ионов водорода/гидроксид-ионов и меняют свой цвет в зависимости от pH раствора.
- Если в растворе избыток ионов водорода, его рН меньше 7 — такие растворы называются кислыми.
- Если количество ионов водорода и гидроксид-ионов одинаковое, они образуют воду. В этом случае в растворе нет избыточных ионов, рН такого раствора примерно равен 7 — такие растворы называются нейтральными.
- Если в растворе избыток гидроксид-ионов, его рН больше 7 — такие растворы называются основными или щелочными.



Далее

Давай с помощью индикаторной бумаги проверим рН разных веществ: лимонная кислота, пищевая сода, хлорид натрия.



Перейти далее

Давай с помощью индикаторной бумаги проверим рН разных веществ: лимонная кислота, пищевая сода, хлорид натрия.



Перейти далее